|
聚合氯化铝_聚合氯化铝厂家-活性污泥法处理技术研究活性污泥法是重要的污水处理工艺之*,已被广泛地应用于处理市政污水和工业废水,其工艺流程通常是将厌氧、缺氧和好氧环境结合起来实现除碳磷和脱氮的功能.活性污泥系统是*个功能*大的微生态系统,其中主要的自养菌是硝化*,即氨氧化*(AOB)与亚硝酸盐氧化菌(NOB).为了实现持续稳定的硝化效果,污水处理厂通常将曝气池中的溶解氧(DO)浓度控制在2 mg·L-1以上.但在较低的DO浓度下,完*混合式或者生物膜反应系统中也能实现完*的硝化作用.如果污水处理厂能在低DO环境下实现稳定达标,那么将大大降低污水厂的运行能耗.本研究通过*个长期运行的缺氧/好氧(A/O)推流式活性污泥小试试验系统,考察系统的脱氮效果和系统内硝化*群落结构随DO浓度变化的规律,探讨低DO生物脱氮的可能性,以期为实际厂在低DO浓度下实现稳定的硝化效果,节约能耗提供可靠的理论依据. 2 材料与方法(Material and methods) 2.1 材料 接种污泥取自北京北小河污水处理厂;进水为人工配水,COD为300~400 mg·L-1,NH4+-N浓度为45~55 mg·L-1,pH控制在7.5~8.5. 2.2 反应器装置和运行条件 采用缺氧/好氧(A/O)推流式活性污泥工艺,缺氧和好氧池总体积为37.5 L,缺氧池/好氧池的体积比为1:4,水力停留时间为9 h;沉淀池体积为24 L,停留时间为3 h.进水流量为96 L·d-1,混合液回流比R=200%,污泥回流比r=150%.实验装置如图 1所示.
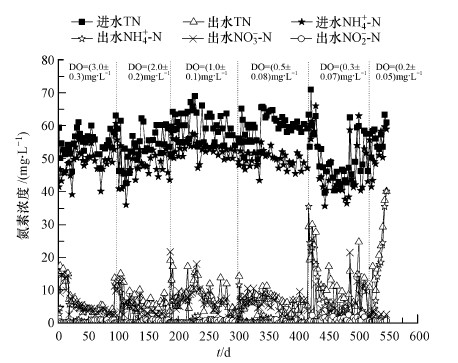
图 1 反应器装置示意图(1.进水桶,2.进水泵,3.A/O反应池,4.搅拌器,5.曝气头,6.内回流泵,7.污泥回流泵,8.二沉池) 在实验过程中,温度维持在20~25 ℃,SRT为20 d,反应器初始污泥浓度在3000 mg·L-1左右.以DO为3 mg·L-1启动反应器,待系统稳定后将DO逐渐降低到2、1、0.5、0.3和0.2 mg·L-1运行,在本研究中,3和2 mg·L-1属于高DO浓度工况,而1、0.5、0.3和0.2 mg·L-1属于低DOI浓度工况. 2.3 水质和污泥性质测定 系统运行期间每隔2~4 d取水样测定进出水水质,采用国标法进行测定,检测项目包括COD、NH4+-N、NO2--N、NO3--N和TN.在每个工况的运行后期采集活性污泥样品,置于-80 ℃保存. MLSS和SVI分别采用马弗炉燃烧减重法和30 min沉降法测定. 2.4 硝化*群落结构分析 2.4.1 DNA的提取 用改进的Zhou法提取活性污泥的DNA,即玻璃珠振荡-SDS-氯仿异戊醇法. 2.4.2 硝化*的聚合酶链式反应(PCR)扩增 AOB的扩增:采用其功能基因amoA的引物对amoA-1F(GGGGTTTCTACTGGTGGT)和amoA-2R(CCCCTCTGCAAAGCCTTCTTC)进行PCR扩增,扩增程序为:94 ℃预变性5 min;94 ℃变性 60 s,51 ℃退火 90 s,72 ℃延伸90 s,共40个循环;*后在72 ℃下延伸10 min,冷却至4 ℃保存. NOB的扩增:对于Nitrobacter,选用F1370 F1(CAGACCGACGTGTGCGAAAG)和F2843 R2(TCCACAAGGAACGGAAGGTC)进行PCR扩增,扩增程序为:94 ℃预变性3 min;94 ℃变性 30 s,55 ℃退火45 s,72 ℃延伸 45 s,共35个循环;后在72 ℃下延伸5 min,冷却至4 ℃保存;对于Nitrospira,选用NSR 1113f(CCTGCTTTCAGTTGCTACCG)和NSR 1264r(GTTTGCAGCGCTTTGTACCG)进行PCR扩增,扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸30 s,共40个循环;*后在72 ℃下延伸15 min,冷却至4 ℃保存. 每种引物对的前端引物附40 bp的GC夹,便于后续的变性梯度凝胶电泳(DGGE)分析,PCR反应的产物用2%琼脂糖凝胶电泳检测. 2.4.3 DGGE分析 将4 μL PCR样品和1.5 μL 6倍加样缓冲液混合,采用Bio-rad突变检测系统,用8%的聚丙烯酰胺凝胶,变性剂浓度为45%~75%,在110 V的电压下60 ℃电泳6 h,用SYBR GREEN I染料对凝胶进行染色,获得DGGE指纹图谱. 2.4.4 基因测序 用洁净的手术刀切取DGGE图谱中的目的条带,利用聚丙烯酰胺DNA回收试剂盒(索莱宝科技公司,北京)进行回收,回收纯化后的DNA用同样的对应引物对进行PCR扩增,产物送上海英骏生物公司进行测序.序列通过NCBI基因库进行在线BLAST比对分析. 2.4.5 相似性和多样性分析 通过比较相似性系数(Cs)来分析样品图谱的相似性.试验所得图像用BIO-RAD的Quantity One软件分析.微生物多样性指数采用Shannon指数(H)表示,公式为:H=-∑PilgPi,其中,Pi=ni/N,ni为峰面积,N为所有峰的总面积. 3 结果讨论(Results and discussion) 3.1 不同DO条件下A/O系统的脱氮效果和污泥性质 3.1.1 不同DO条件下A/O系统的脱氮效果 图 2和图 3分别显示了在不同DO条件下A/O小试系统内进出水的氮素浓度和去除率.硝化过程是耗氧反应,当小试系统曝气池中的DO浓度维持在3 mg·L-1和2 mg·L-1时,系统在很短的时间内*能实现很好的硝化效果,当改变曝气池中的溶解氧浓度,系统在几天之内氨氮的去除率即可稳定.当把系统曝气池中的DO调至1 mg·L-1时,由于突然从高DO状态调节至低DO状态,运行初始阶段出水水质存在波动,但经过2周左右的培养和驯化后出水氨氮和总氮均达到了稳定状态,继续降低曝气池中的DO浓度,使其维持在0.5 mg·L-1时,出水氨氮和总氮并未出现较大的波动,氨氮的平均去除率均为98%以上,总氮的平均去除率为85%以上.当进*步降低DO至0.3 mg·L-1时,尽管经过30 d的连续运行,氨氮的平均去除率下降到了95.4%,总氮的平均去除率为83.46%,整个过程出水水质波动较大,难以达到稳定的状态. 然而,当DO继续降低到0.2 mg·L-1时,系统出现了大幅度波动,出水氨氮和总氮浓度非常高,连续运行了30 d后,出水水质也未达标. 这些水质结果表明该系统的运行DO浓度只能降低到0.5 mg·L-1.
图 2 A/O小试系统内进出水的氮素浓度
图 3 A/O小试系统内氨氮和总氮的去除率 传统生物脱氮过程的硝化反应是在好氧条件下进行的,氧气作为电子受体,氮元素作为电子供体,将氨氮氧化为硝酸盐氮.因此,为了能充分实现硝化反应,污水处理厂往往将DO设计到2 mg·L-1以上(Park et al.,2004). 根据本研究的结果,在DO为0.5 mg·L-1的情况下,系统也能很好地实现硝化作用,这样可以大幅度节约硝化反应所需要的能源.当DO从0.5 mg·L-1继续降低到0.3 mg·L-1甚至到0.2 mg·L-1,系统曝气池中的硝化效果受到了较大的制约,这可能是因为在此DO浓度下曝气池中污泥易于沉降,泥水难以达到充分的混合.为了保证在此浓度下依然能达到较好的脱氮效果,可以在曝气池中加装搅拌器通过搅拌作用使泥水充分混合,但这会增加能量的消耗.另外,还可以通过增大污泥停留时间(SRT)来补偿低DO工况下由于氧气不足所造成的脱氮效果下降. Liu等(2013)的研究结果也证明了这*点,他们考察了SRT为10 d和40 d两种情况下,当DO降低到0.2 mg·L-1以下时,在SRT为10 d的系统中硝化效果很难达到稳定,而在SRT为40 d的系统中硝化效果较为稳定. 3.1.2 不同DO条件下A/O系统的MLSS和SVI的变化规律 随着DO浓度的降低,活性污泥的MLSS和SVI均呈上升趋势. MLSS增加的幅度不是很大,DO为3、2、1、0.5和0.3 mg·L-1时,系统达到相对稳定状态时活性污泥的平均MLSS分别为3925、4155、4550、4910和5150 mg·L-1.总的来说,MLSS随着DO的降低而增加,这也与其它文献报道的研究结果相*致.SVI也是随着DO的降低而升高,系统内的DO为3和2 mg·L-1时,活性污泥的SVI值在60~100 mL·g-1之间,活性污泥具有很好的沉降性能. DO为1 mg·L-1的工况下,活性污泥的SVI值在100~120 mL·g-1之间,沉降和凝聚性能依然很*.DO为0.5 mg·L-1时,活性污泥的SVI值在140~160 mL·g-1之间,也属于较正常的范围.但当DO浓度降低到0.3 mg·L-1运行时,系统中的活性污泥的SVI值在160~180 mL·g-1之间,处于膨胀状态,这也很好地证明了DO浓度为0.3 mg·L-1时,系统出水水质很难稳定达标的结果. 3.2 硝化*群落分析 3.2.1 AOB群落结构和多样性变化 5个不同DO工况下AOB的amoA功能基因DGGE图谱如图 4a所示.由图可以看出,各个工况下的AOB菌群丰富度相对较单*,共检测到8条优势条带,分别标记为1~8. AOB的群落结构随着DO浓度的降低而发生了变化,在每个工况下都存在的优势*为条带4和6所代表的*. 当DO降低后,DO浓度为3 mg·L-1时存在的优势条带7却消失了,而且在DO浓度为0.5 mg·L-1时,出现了新的优势条带5.
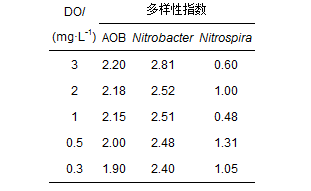
图 4 不同DO条件下AOB的DGGE图谱(a)和所有条带的检测示意图(b) 图 4b显示,从高DO变化到低DO,系统内AOB群落结构的动态变化率约为20%~40%,属于中等程度的变化(Miura et al.,2007; Wang et al.,2012),高DO(3和2 mg·L-1)和低DO(1、0.5和0.3 mg·L-1)环境中AOB种群多样性指数(H)较为相似(表 1).在不同的DO环境下,A/O小试系统中AOB的多样性均处于较高的水平.DO为3 mg·L-1时小试A/O系统中AOB的多样性zui高,AOB的种群多样性随DO浓度的降低而减小,但减小的幅度很小,DO的降低并未对AOB的群落结构造成太大的影响,系统中各种优势*分布的均匀性和稳定性使得系统中AOB群落始终处于很稳定的状态,保证了系统氨氧化功能的稳定性. 表 1 不同DO条件下各种硝化*的多样性指数(H) Table 1 Shannon index of nitrifying bacteria under different DO conditions
图 4a中标有阿拉伯数字的优势条带的测序结果显示(表 2),AOB均属于Nitrosomonas,未检测出有Nitrosospira,其中,条带1、2、3和4属于Nitrosomonas-like cluster,条带 5属于Nitrosomonas europaea,条带6和7均为Nitrosomonas oligotropha所属的*.条带5和7均属于低DO(0.5 mg·L-1)环境中的优势AOB,由此说明,所属Nitrosomonas europaea和Nitrosomonas oligotropha 的AOB均可在低DO的环境中生存,特别是Nitrosomonas europaea所属的AOB非常适合在0.5 mg·L-1的DO浓度下生存.这*结果也与其他研究者的结果相*致(Park et al.,2008; Liu et al.,2013). 表 2 DGGE条带的测序结果 Table 2 Sequencing analysis of DNA from DGGE bands
3.2.2 NOB群落中Nitrobacter群落结构的变化 由图 5a可知,Nitrobacter的群落结构随DO的降低发生了明显的变化,高DO环境(3和2 mg·L-1)的Nitrobacter群落与低DO环境(1、0.5和0.3 mg·L-1)的Nitrobacter群落结构存在较大的差异,DO为1和0.5 mg·L-1工况下Nitrobacter的群落结构相似,共同的优势种群为条带Nb1、Nb2、Nb3、Nb4、Nb5、Nb6、Nb7,Nb8则在DO为0.5 mg·L-1的环境下*为丰富,Nb18是DO为1 mg·L-1工况下存在的优势条带.当DO继续降低至0.3 mg·L-1时,系统中的优势种群转变为Nb4、Nb21、Nb22、Nb23,系统中的优势种群数量明显降低.
图 5 不同DO条件下Nitrobacter的DGGE图谱(a)和所有条带的检测示意图(b) 图 5b显示,DO为1和0.5 mg·L-1工况下的Nitrobacter群落结构相似,高DO(3和2 mg·L-1)和低DO(1、0.5和0.3 mg·L-1)环境下Nitrobacter的群落结构相似性较低,不同DO环境中的Nitrobacter群落结构差异较大,但1、0.5和0.3 mg·L-1工况下的Nitrobacter群落结构相似性较高. Shannon-Weiner 指数(H)显示(表 1),不同DO环境下的Nitrobacter群落结构差异较大,但每个DO工况下的优势种群数量均较高,优势*的均匀性也较高,因此,每个DO工况下的Nitrobacter群落均处于稳定状态,保证了系统硝化功能的稳定性. 测序结果显示(表 2),系统中鉴定出的Nitrobacter可分为3类,分别为Group1 Nitrobacter、Group2 Nitrobacter和Group3 Nitrobacter,其中,Nb1、Nb2、Nb3、Nb4、Nb5、Nb6、Nb7、Nb8、Nb9、Nb21、Nb22和Nb23属于Group1 Nitrobacter,也是数量多的*类Nitrobacter,Nb15、Nb16、Nb17、Nb18、Nb19和Nb20属于Group2 Nitrobacter,Nb12、Nb13和Nb14属于Group3 Nitrobacter.因此,结合图 5b可以进*步看出,系统DO从高浓度(3、2 mg·L-1)降低到低浓度(1、0.5和0.3 mg·L-1)时,系统中的Nitrobacter的种类从Group2和Group3转变成了Group1.另外,从测序结果也可以看出,N. winogradskyi系统中的优势Nitrobacter,但在高低DO工况下,它们属于不同的发育分支. 3.2.3 NOB群落中Nitrospira群落结构的变化 由图 6a可知,不同DO条件下的Nitrospira群落结构变化较小,系统中的优势*始终为Np3和Np4,相比于有着丰富群落结构的Nitrobacter,系统中Nitrospira的优势种群较少.
图 6 不同DO条件下Nitrospira的DGGE图谱(a)和所有条带的检测示意图(b) 图 6b显示了Nitrospira的DGGE图谱的条带分布、*度及每个工况的DGGE图谱各样品间的相似性.总体而言,不同DO条件下小试A/O系统曝气池中的Nitrospira种群相似性较高,种群结构没有发生较大的改变. 高DO(3和2 mg·L-1)和低DO(1、0.5和0.3 mg·L-1)环境下Nitrospira的群落结构相似性较高,从高DO变化到低DO,系统内*群落结构的动态变化率约为10%~40%,变化程度较小.因此,DO的变化并未对Nitrospira的种群结构和多样性产生较大的影响,不同DO环境中的Nitrospira群落结构相类似. Shannon-Weiner 指数(H)显示(表 1),高DO下的Nitrospira多样性相对较低,而在0.5 mg·L-1的系统中,两种Nitrospira均为优势菌,其均匀度较高,因此,相应的多样性指数较高. 测序结果显示(表 2),系统中鉴定出的Nitrospira均属于Group1 Nitrospira,系统中并未检测出Group2 Nitrospira中的*,Np1、Np2、Np3、Np4所代表的*均属于同*类*,而且同源性很高,由此也说明,小试A/O系统中Nitrospira的种类较单*,相比于Nitrobacter丰富的种群,Nitrospira的种类较少. 这也与类似的研究结果相*致(Park et al.,2008). 由Nitrobacter和Nitrospira的多样性指数可以看出,小试A/O系统中主要的NOB为Nitrobacter.虽然Liu等(2013)的研究结果表明,在长期的低DO环境下,Nitrospira-like比Nitrobacter-like的NOB数量*多,但Nitrobacter和Nitrospira具有不同的生存策略,Nitrospira遵循的是K策略,*适应于在低浓度的亚硝酸盐环境中生存,Nitrobacter的生长实行的是r策略,在亚硝酸盐浓度很低的环境中竞争不过Nitrospira,但当有足够的亚硝酸盐存在时,Nitrobacter的生长速度比Nitrospira*快. 在缺少亚硝酸盐的环境中,Nitrospira的含量*丰富,而在本研究的A/O系统中亚硝酸盐并不是NOB生长的限制因子,因此,Nitrobacter是小试A/O系统中*主要的NOB,主要贡献了亚硝酸盐的氧化作用. 4 结论(Conclusions) 1)当DO浓度从3 mg·L-1降低到0.5 mg·L-1时,本研究中的推流式A/O小试系统仍然能保持很好的脱氮效果,氨氮和总氮的去除率分别达到了98%和85%以上;当DO进*步降低到0.3和0.2 mg·L-1时,出水水质指标不能达标,系统运行难以达到稳定状态. 2)PCR-DGGE的解析结果表明,A/O小试系统中AOB群落结构的动态变化水平约为20%~40%,Nitrospira群落结构的动态变化水平约为10%~40%,AOB和Nitrospira的群落结构随DO的变化并不显著. 而Nitrobacter的群落结构随DO的降低发生了明显的变化,不同DO环境中的Nitrobacter群落结构存在较大差异.具体参见资料或*多相关技术文档。 3)测序结果表明,A/O小试系统活性污泥中的优势AOB主要为Nitrosomonas oligotropha、Nitrosomonas-like和Nitrosomonas europaea,Nitrosomonas oligotropha的AOB*适宜在低DO的环境中生存. 系统中的Nitrobacter包括Group1 Nitrobacter、Group2 Nitrobacter和Group3 Nitrobacter 3类中的*,其中,Group1 Nitrobacter是*多的*类Nitrobacter,也是适应在低DO环境下生存的Nitrobacter.小试A/O系统中Nitrospira主要的优势菌种始终是Group 1 Nitrospira. 以上资料泽源净水-聚合氯化铝厂家为您整理。 |